2022 — Rapports de la vérificatrice générale du Canada au Parlement du CanadaRapport 9 — Les vaccins contre la COVID-19
Rapport de l’auditeur indépendant
Table des matières
- Introduction
- Constatations et recommandations
- Approvisionnement en vaccins contre la COVID‑19 et autorisation des vaccins
- Répartition et distribution des vaccins
- Surveillance des vaccins
- Conclusion
- À propos de l’audit
- Recommandations et réponses
- Pièces :
- 9.1 — Santé Canada a accéléré ses processus liés à l’autorisation des vaccins au cours de la pandémie de COVID‑19
- 9.2 — À la fin de mai 2022, l’Agence de la santé publique du Canada avait livré toutes les doses de vaccins demandées par les provinces et les territoires
- 9.3 — La plupart des doses inutilisées au Canada atteindront leur date de péremption avant la fin de 2022
Introduction
Contexte
9.1 Les vaccins sont considérés comme l’un des plus importants outils de santé publique disponibles pour la prévention de maladies graves et le contrôle d’éclosions de maladies infectieuses. L’évolution rapide de la pandémie de maladie à coronavirus (COVID‑19)Définition 1 déclarée en mars 2020 et la grande demande en vaccins dans le monde entier ont pressé le gouvernement fédéral pour qu’il intervienne rapidement concernant l’approbation, l’approvisionnement, la distribution et la surveillance des vaccins contre la COVID‑19.
9.2 L’objectif du Plan de vaccination du Canada contre la COVID‑19 : sauver des vies et protéger les moyens de subsistance, mis en place par les gouvernements fédéral, provinciaux et territoriaux en décembre 2020, était de permettre au plus grand nombre possible de Canadiennes et de Canadiens d’être vaccinés le plus rapidement possible contre la COVID‑19, tout en veillant à ce que les populations à haut risque soient prioritaires.
9.3 Au Canada, l’approbation et le lancement de la vaccination ont commencé en décembre 2020 pour les adultes, en mai 2021 pour les adolescentes et adolescents, en novembre 2021 pour les enfants de 5 ans à 11 ans et en juillet 2022 pour les enfants de 6 mois à 5 ans.
9.4 Au Canada, la santé publique est une responsabilité partagée entre le gouvernement fédéral, les provinces et les territoires. La logistique de distribution des vaccins relève normalement des provinces et des territoires. Au cours de la pandémie de COVID‑19, le gouvernement fédéral a assumé les frais des vaccins et de la logistique de distribution aux provinces et aux territoires et s’est occupé de la gestion de la logistique. La réponse du Canada en matière de vaccination contre la COVID‑19 a impliqué la collaboration entre le gouvernement du Canada, les gouvernements provinciaux et territoriaux, les organisations autochtones, les administrations municipales, les spécialistes de la santé publique et de la logistique, les compagnies de vaccins et la population canadienne.
9.5 Gouvernements provinciaux et territoriaux — Les gouvernements des provinces et des territoires sont responsables de l’établissement des priorités pour la distribution des vaccins selon la population et de la gestion des doses initiales et subséquentes au sein de leur administration respective, en tenant compte des avis donnés par le gouvernement fédéral. Les provinces et territoires sont également responsables de demander la quantité adéquate de doses et les types de vaccins nécessaires à la vaccination de leur population et de fournir au gouvernement fédéral des renseignements sur la couverture et l’innocuité des vaccins au sein de ces populations.
9.6 Agence de la santé publique du Canada — L’Agence est l’organisme fédéral responsable de faciliter les approches nationales en matière de santé publique en collaboration avec les agences ou les ministères de la santé provinciaux et territoriaux. En ce qui concerne les vaccins contre la COVID‑19, l’Agence est chargée de déterminer les besoins, de payer les compagnies de vaccins, de répartir les vaccins et de les distribuer aux provinces et aux territoires et d’en assurer la surveillance.
9.7 Santé Canada — Le Ministère est chargé d’autoriser les vaccins avant qu’ils soient rendus disponibles au Canada. Avant d’autoriser un vaccin en particulier, le Ministère détermine si les bienfaits du vaccin surpassent les risques possibles. Le Ministère continue également de surveiller l’innocuité et l’efficacité des vaccins après le début de leur utilisation.
9.8 Services publics et Approvisionnement Canada — Le Ministère achète des biens et des services au nom des ministères et organismes fédéraux. Il était responsable de diriger les négociations avec les compagnies de vaccins contre la COVID‑19 et d’établir des ententes avec elles au nom de l’Agence de la santé publique du Canada.
Objet de l’audit
9.9 Cet audit visait à déterminer si :
- Services publics et Approvisionnement Canada avait fourni un soutien adéquat en matière d’approvisionnement pour obtenir des vaccins contre la COVID‑19;
- l’Agence de la santé publique du Canada et Santé Canada avaient assuré un accès aux vaccins contre la COVID‑19 de façon efficace;
- la surveillance exercée par l’Agence de la santé publique du Canada et Santé Canada à l’égard des vaccins contre la COVID‑19 était efficace et opportune.
9.10 Cet audit est important parce que des facteurs tels que les voyages internationaux, l’urbanisation et les changements climatiques accroissent la probabilité que des urgences de santé publique comme celle de la pandémie de COVID‑19 se produisent. La vaccination généralisée est l’un des meilleurs outils de protection de la population contre les maladies infectieuses. Afin de réduire la mortalité, les hospitalisations et les répercussions négatives sur la santé de la population canadienne ainsi que sur son bien‑être social et économique lors des futures urgences de santé publique, il est important d’apprendre de cette pandémie et de mieux se préparer aux futures urgences de santé publique.
9.11 Même si nous avions accès aux ententes d’achat anticipéDéfinition 2 conclues pour l’achat de vaccins contre la COVID‑19 et aux documents connexes, nous devons limiter les renseignements que nous présentons étant donné les clauses de confidentialité des ententes. De plus, nous n’avons pas audité de décisions fondées sur la science.
9.12 La section intitulée À propos de l’audit, à la fin du présent rapport, donne des précisions sur l’objectif, l’étendue, la méthode et les critères de l’audit.
Constatations et recommandations
Message général
9.13 Dans l’ensemble, l’Agence de la santé publique du Canada et Santé Canada, avec l’appui de Services publics et Approvisionnement Canada, ont répondu au caractère urgent d’une pandémie de coronavirus en évolution rapide en collaborant afin d’obtenir un nombre suffisant de doses de vaccins contre la COVID‑19 pour que les provinces et les territoires puissent vacciner chaque personne qui habite au Canada. À la fin de mai 2022, l’Agence avait communiqué qu’environ 82 % des personnes admissibles à la vaccination à ce moment avaient reçu au moins deux doses. Il s’agissait du plus important programme de vaccination de masse de l’histoire du Canada.
9.14 Bien que le gouvernement ait réussi à envoyer un nombre suffisant de doses aux provinces et aux territoires, l’Agence de la santé publique du Canada s’est retrouvée avec un important excédent de doses. Cela a mené à des pertes de vaccins, puisque certaines doses ont atteint leur date de péremption avant d’avoir pu être utilisées ou données. À la fin de mai 2022, il y avait 32,5 millions de doses en stock et, à l’aide de documents non classifiés et publics, nous avons estimé que ces doses valaient environ un milliard de dollars. La majorité de ces doses atteindront leur date de péremption à la fin de 2022, ce qui entraînera davantage de gaspillage si elles ne sont pas utilisées ou données bientôt. Le Canada, tout comme d’autres pays, essaie de faire don de ses stocks excédentaires. En outre, il y a eu des retards dans la mise en application du système informatique que l’Agence de la santé publique du Canada avait acquis pour assurer le suivi de la distribution et de l’utilisation des doses de vaccins, ce qui a nécessité des solutions de rechange pour la gestion des stocks. Les fonctionnalités du système n’étaient pas toutes utilisées à la fin de la période visée par notre audit.
9.15 À cause de problèmes connus qui n’ont pas été réglés avant la pandémie, la communication des données détaillées sur les cas relativement à la surveillance des vaccins contre la COVID‑19 n’était pas aussi efficace qu’elle aurait dû l’être. Lorsque la pandémie a commencé au début de 2020, l’Agence de la santé publique du Canada n’avait pas établi de réglementation ou conclu d’ententes avec les provinces et territoires afin de clairement préciser le type de renseignements de santé publique à communiquer et la façon de le faire. À la fin de la période visée par notre audit, l’Agence n’avait pas obtenu la permission de toutes les provinces et de tous les territoires lui permettant de communiquer les renseignements détaillés sur les cas à propos de l’innocuité des vaccins à Santé Canada, aux compagnies de vaccins et à l’Organisation mondiale de la Santé. L’échange de données demeurera important alors que de nouveaux vaccins sont mis au point et fabriqués, y compris au Canada, pour veiller à la sécurité de la population canadienne.
Approvisionnement en vaccins contre la COVID‑19 et autorisation des vaccins
Services publics et Approvisionnement Canada avait obtenu un approvisionnement suffisant de doses de vaccins pour le Canada
9.16 Nous avons constaté que Services publics et Approvisionnement Canada avait fourni un soutien efficace en matière d’approvisionnement à l’Agence de la santé publique du Canada. Peu de temps après la formulation des recommandations sur les vaccins potentiels par le Groupe de travail sur les vaccins contre la COVID‑19 du Canada, Services publics et Approvisionnement Canada a obtenu un approvisionnement suffisant de doses de vaccins contre la COVID‑19 pour répondre aux besoins de la population canadienne.
9.17 L’analyse à l’appui de cette constatation porte sur :
- un soutien efficace en matière d’approvisionnement;
- un nombre suffisant de doses de vaccins obtenus.
9.18 Cette constatation est importante parce que les vaccins étaient nécessaires rapidement pour réduire le risque de maladie grave, d’hospitalisation et de décès des suites de la COVID‑19 dans la population canadienne. Malgré l’urgence d’obtenir des doses de vaccins, leur approvisionnement devait être effectué avec diligence raisonnable.
9.19 Au début de la pandémie, il y avait de l’incertitude quant aux vaccins contre la COVID‑19 qui seraient mis au point et autorisés ainsi qu’au moment où ils seraient prêts à être distribués. Cette incertitude a créé une demande élevée à l’échelle mondiale pour des vaccins sûrs et efficaces et a mis de la pression sur les gouvernements pour qu’ils concluent des ententes avec les compagnies de vaccins. L’incertitude entourant l’approvisionnement en vaccins a rendu le marché hautement concurrentiel. Dans ces conditions, des paiements anticipés étaient exigés et des obligations d’achat d’une quantité minimale étaient imposées. En outre, le Canada disposait d’une capacité nationale de production de vaccins très limitée et dépendait donc des produits importés d’ailleurs dans le monde.
9.20 Le gouvernement fédéral a mis sur pied le Groupe de travail sur les vaccins contre la COVID‑19, lequel était constitué de scientifiques et de spécialistes du secteur, qui a offert des recommandations sur le recensement et la sélection des vaccins. Le Groupe de travail a tenu sa première réunion le 16 juin 2020 et a émis une lettre d’avis le 29 juin 2020.
Un soutien efficace en matière d’approvisionnement
9.21 Nous avons constaté que Services publics et Approvisionnement Canada avait fourni un soutien efficace en matière d’approvisionnement à l’Agence de la santé publique du Canada pour l’obtention de vaccins contre la COVID‑19. Le Ministère avait modifié son processus d’approvisionnement dès le début de la pandémie afin de permettre le recours à son pouvoir de passation de marchés en cas d’urgence pour l’approvisionnement en vaccins. Ce pouvoir permettait au Ministère d’obtenir des vaccins auprès des compagnies recommandés par le Groupe de travail sur les vaccins contre la COVID‑19 au moyen d’un processus non concurrentiel.
9.22 Services publics et Approvisionnement Canada a commencé à négocier avec les compagnies de vaccins après avoir obtenu les recommandations du Groupe de travail sur les vaccins contre la COVID‑19 à la fin juin 2020. Au nom de l’Agence de la santé publique du Canada et avec son approbation, Services publics et Approvisionnement Canada a conclu des ententes d’achat anticipé avec sept compagnies qui avaient démontré le potentiel de mettre au point des vaccins viables, avec l’objectif d’obtenir différents types de vaccins contre la COVID‑19 et assez de doses pour vacciner entièrement chaque personne admissible au Canada.
9.23 Nous avons constaté que, bien qu’un processus non concurrentiel ait été utilisé, Services publics et Approvisionnement Canada a fait preuve de diligence raisonnable pour les sept compagnies de vaccins en procédant à des évaluations dans le but d’examiner la capacité financière des sociétés de répondre aux exigences et en effectuant des vérifications de l’intégrité pour atténuer le risque de pratiques commerciales contraires à l’éthique. Nous n’avons constaté aucun problème relativement à la délégation des pouvoirs puisque la ministre des Services publics et de l’Approvisionnement avait signé les sept ententes d’achat anticipé.
Un nombre suffisant de doses de vaccins obtenues
9.24 Au 19 janvier 2021, Services publics et Approvisionnement Canada avait conclu sept ententes d’achat anticipé pour obtenir jusqu’à 414 millions de doses potentielles. Ces ententes comprenaient des paiements anticipés pour appuyer la mise au point, la mise à l’essai et la fabrication à risque des vaccins. La stratégie consistait à conclure des ententes avec plusieurs compagnies de vaccins au cas où Santé Canada n’autoriserait qu’un seul vaccin ou un petit nombre de vaccins. Les ententes ont été conclues avec les compagnies suivantes (en ordre chronologique) :
- Moderna — le 24 juillet 2020
- Sanofi — le 11 septembre 2020
- Pfizer — le 26 octobre 2020
- Medicago — le 13 novembre 2020
- AstraZeneca — le 21 novembre 2020
- Johnson & Johnson — le 30 novembre 2020
- Novavax — le 19 janvier 2021
Le Ministère a également travaillé avec les compagnies de vaccins pour assurer une livraison la plus rapide possible. L’approvisionnement en doses supplémentaires des vaccins suivants a eu lieu afin de répondre à de nombreux facteurs émergents tels que les retards de livraison et le besoin de doses de rappel :
- En février 2021, une entente avec Verity Pharmaceuticals Canada Inc. et le Serum Institute of India a été signée pour rapidement importer au Canada 2 millions de doses du vaccin d’AstraZeneca.
- En mars 2021, environ 5 millions de doses supplémentaires du vaccin d’AstraZeneca ont été obtenues alors qu’il y avait des retards dans l’obtention de doses auprès d’autres compagnies de vaccins.
- En avril et en août 2021, deux modifications ont été apportées pour obtenir jusqu’à 280 millions de doses supplémentaires de vaccins de Moderna et de Pfizer sur trois ans (de 2022 à 2024).
- Services publics et Approvisionnement Canada a réservé des vaccins auprès de Pfizer, de Moderna, de Novavax et de Medicago pour 2022 et 2023, avec des options de prolongation jusqu’en 2024. En ce qui concerne les doses de Sanofi, les livraisons allaient être confirmées si l’autorisation du vaccin était reçue.
9.25 Le 27 juillet 2021, le gouvernement du Canada a annoncé que le Canada avait reçu plus de 66 millions de doses de vaccins contre la COVID‑19. Cela signifiait qu’il y avait assez de doses pour vacciner entièrement (deux doses par personne) chaque personne admissible au Canada à ce moment (les personnes âgées de 12 ans et plus). L’objectif du gouvernement fédéral de fournir des vaccins à toutes les personnes qui en désiraient avant l’automne 2021 était atteint.
9.26 Pour protéger les renseignements confidentiels commerciaux contenus dans les ententes d’achat anticipé, nous avons utilisé de l’information publique et des renseignements non classifiés pour estimer qu’au 31 mai 2022, le coût moyen d’une dose était d’environ 30 $, excluant les taxes applicables. Le coût estimé d’une dose variera au fil du temps sous l’effet de divers facteurs, notamment en raison des variations des taux de change et des forces du marché, par exemple, l’offre et la demande. Par conséquent, à la fin de la période visée par l’audit, le gouvernement du Canada avait dépensé environ 5 milliards de dollars pour les 169 millions de doses de vaccins livrées entre décembre 2020 et mai 2022 (voir la pièce 9.3, qui se trouve après le paragraphe 9.55).
Santé Canada a accéléré l’autorisation des vaccins
9.27 Nous avons constaté que Santé Canada avait adapté son processus d’autorisation habituel pour accélérer l’approbation réglementaire afin d’autoriser les vaccins contre la COVID‑19 avant qu’ils soient offerts au Canada. Nous avons constaté que le processus accéléré comptait les mêmes étapes clés que le processus habituel d’autorisation des vaccins, mais qu’il avait été ajusté pour permettre une présentation des vaccins en continu tout au long de la période d’examen.
9.28 L’analyse à l’appui de cette constatation porte sur :
9.29 Cette constatation est importante parce que malgré le besoin urgent d’un vaccin contre la COVID‑19, un processus d’autorisation de vaccins accéléré exigeait le même niveau de diligence que le processus habituel d’autorisation des vaccins.
Le processus accéléré d’autorisation des vaccins
9.30 Nous avons constaté que Santé Canada suivait un processus systématique pour autoriser les vaccins contre la COVID‑19 utilisés au Canada. (Nous n’avons pas audité les décisions fondées sur la science concernant l’autorisation des vaccins.) Étant donné le besoin urgent de vaccins contre la COVID‑19, le Ministère a adapté son processus d’examen habituel pour accélérer le processus d’autorisation des vaccins. Le processus accéléré, mis en place au moyen d’un arrêté d’urgence, permettait aux compagnies de soumettre une demande partiellement remplie, c’est‑à‑dire une présentation en continu, au moment du dépôt initial auprès de Santé Canada. Santé Canada commençait son évaluation à l’aide des renseignements initiaux et acceptait de nouvelles données probantes lorsqu’elles étaient disponibles, jusqu’à ce que la demande soit jugée complète. Il s’agit d’une approche différente du processus habituel d’autorisation des drogues dans le cadre du Règlement sur les aliments et drogues, lequel exige que tous les renseignements soient fournis au moment de soumettre la demande.
9.31 Nous avons comparé les étapes nécessaires à l’autorisation des vaccins contre la COVID‑19 dans le cadre du processus accéléré avec le processus du Règlement sur les aliments et drogues. Nous avons constaté que Santé Canada suivait les exigences du Règlement pour l’examen des données scientifiques, même si elles n’étaient pas toutes reçues au même moment. Par exemple, nous avons constaté que Santé Canada avait effectué des évaluations cliniques et des évaluations qualité des données fournies par les compagnies de vaccins.
9.32 Le Ministère avait une équipe attitrée de scientifiques qui examinaient les demandes pour les vaccins, et nous avons aussi observé que des superviseures et des superviseurs avaient vérifié ces examens. De plus, le personnel affecté aux travaux d’examen réglementaire avait accès à des directives, à des procédures opérationnelles normalisées et à des séances d’information. L’arrêté d’urgence conférait le pouvoir d’imposer des conditions en lien avec toute autorisation. Nous avons constaté que les vaccins avaient été autorisés avec des conditions qui exigeaient notamment que les compagnies de vaccins fournissent des données d’innocuité, d’efficacité et de qualité afin d’appuyer les efforts déployés par Santé Canada pour surveiller l’innocuité des vaccins contre la COVID‑19. (Voir la pièce 9.1 pour connaître la chronologie d’autorisation d’un échantillon de vaccins.)
Pièce 9.1 — Santé Canada a accéléré ses processus liés à l’autorisation des vaccins au cours de la pandémie de COVID‑19Note *
|
11 mars 2020 |
Déclaration par l’Organisation mondiale de la Santé que l’éclosion de COVID‑19 est une pandémie |
|
16 septembre 2020 |
Arrêté d’urgence concernant l’importation, la vente et la publicité de drogues à utiliser relativement à la COVID‑19 |
|
1er octobre 2020 |
Réception de la première présentation d’AstraZeneca par Santé Canada |
|
9 octobre 2020 |
Réception de la première présentation de Pfizer par Santé Canada |
|
12 octobre 2020 |
Réception de la première présentation de Moderna par Santé Canada |
|
30 novembre 2020 |
Réception de la première présentation de Johnson & Johnson par Santé Canada |
|
9 décembre 2020 |
Autorisation par Santé Canada du vaccin de Pfizer pour les personnes âgées de 16 ans et plus |
|
23 décembre 2020 |
Autorisation par Santé Canada du vaccin de Moderna pour les personnes âgées de 18 ans et plus |
|
29 janvier 2021 |
Réception de la première présentation de Novavax par Santé Canada |
|
26 février 2021 |
Autorisation par Santé Canada du vaccin d’AstraZeneca pour les personnes âgées de 18 ans et plus Autorisation par Santé Canada du vaccin d’AstraZeneca fabriqué par le Serum Institute of India pour les personnes âgées de 18 ans et plus (cette autorisation prend fin le 16 septembre 2021) |
|
5 mars 2021 |
Autorisation par Santé Canada du vaccin de Johnson & Johnson pour les personnes âgées de 18 ans et plus |
|
18 mars 2021 |
Adoption du Règlement modifiant le Règlement sur les aliments et drogues pour y inclure le processus accéléré lié à la COVID‑19 |
|
19 avril 2021 |
Réception de la première présentation de Medicago par Santé Canada |
|
5 mai 2021 |
Autorisation par Santé Canada du vaccin de Pfizer pour les personnes âgées de 12 ans et plus |
|
27 août 2021 |
Autorisation par Santé Canada du vaccin de Moderna pour les personnes âgées de 12 ans et plus |
|
19 novembre 2021 |
Autorisation par Santé Canada du vaccin de Pfizer pour les personnes âgées de 5 ans et plus |
|
17 février 2022 |
Autorisation par Santé Canada du vaccin de Novavax pour les personnes âgées de 18 ans et plus |
|
24 février 2022 |
Autorisation par Santé Canada du vaccin de Medicago pour les personnes âgées de 18 ans à 64 ans |
|
17 mars 2022 |
Autorisation par Santé Canada du vaccin de Moderna pour les personnes âgées de 6 ans à 11 ans |
|
Sources : Organisation mondiale de la Santé et diverses sources du gouvernement fédéral |
|
9.33 Santé Canada a indiqué que, bien qu’il soit accéléré, le processus d’autorisation des vaccins contre la COVID‑19 respectait les normes pour l’examen des vaccins (innocuité, efficacité et qualité) du Règlement sur les aliments et drogues. En mars 2021, le Règlement a été modifié pour inclure le processus accéléré d’autorisation des vaccins contre la COVID‑19.
Répartition et distribution des vaccins
9.34 La mise en œuvre d’un programme de vaccination à l’échelle du Canada garantissant une répartition et une distribution équitablesDéfinition 3 et donnant la priorité aux populations à haut risque nécessitait de la collaboration et de la planification. La réponse du Canada relativement à la vaccination exigeait la collaboration entre le gouvernement du Canada et d’autres parties prenantes, notamment les provinces, les territoires, les représentantes et représentants des groupes autochtones, des spécialistes de la logistique et les compagnies de vaccins.
9.35 Le Comité consultatif national de l’immunisation du Canada est constitué de spécialistes provenant de partout au Canada dans les domaines de l’immunisation, des maladies infectieuses, de l’épidémiologie, entre autres, et fournit des directives sur l’utilisation des vaccins depuis 1964. En ce qui concerne les vaccins contre la COVID‑19, le Comité avait fourni des directives à l’Agence de la santé publique du Canada concernant l’administration prioritaire des premières doses. Le Comité avait également formulé des recommandations pour appuyer la prise de décisions dans le cadre de la vaccination contre la COVID‑19 à l’échelle provinciale et territoriale. Le Comité tient compte de facteurs précis, tels que l’économie, l’éthique, l’équité, la faisabilité et l’acceptabilité, lorsqu’il offre des conseils. Il avait recensé les populations à haut risque suivantes :
- les personnes qui présentent un risque élevé de développer une forme grave de la COVID‑19 et d’en décéder;
- les personnes les plus susceptibles de transmettre la COVID‑19 aux personnes qui présentent un risque élevé de développer une forme grave de la COVID‑19 et d’en décéder et le personnel essentiel au maintien de la réponse à la COVID‑19;
- les personnes qui contribuent au maintien d’autres services essentiels au fonctionnement de la société;
- les personnes dont les conditions de vie ou de travail accroissent leur risque d’infection et les personnes dont l’infection pourrait avoir des conséquences disproportionnées, notamment pour les collectivités autochtones.
9.36 Au cours de la pandémie, l’Agence de la santé publique du Canada a, pour la première fois, joué le rôle principal dans la gestion de la distribution des vaccins des compagnies aux provinces et aux territoires. Il s’agissait notamment de la gestion des exigences logistiques pour les différents vaccins, y compris leur disponibilité, l’échéancier, l’entreposage, l’emballage, l’expédition et le maintien de la chaîne du froid (c’est‑à‑dire le maintien des vaccins à des températures précises pendant leur entreposage et leur expédition).
L’Agence de la santé publique du Canada a équitablement réparti les doses de vaccins aux provinces et aux territoires et a distribué les doses demandées en temps opportun
9.37 Nous avons constaté que l’Agence de la santé publique du Canada avait équitablement réparti les vaccins contre la COVID‑19 aux provinces et aux territoires tout en accordant la priorité aux populations à haut risque. Nous avons également constaté que l’Agence avait livré les doses demandées aux provinces et aux territoires en temps opportun.
9.38 L’analyse à l’appui de cette constatation porte sur :
- la répartition équitable des doses de vaccins;
- la distribution en temps opportun aux provinces et aux territoires.
9.39 Cette constatation est importante parce qu’il était primordial que les provinces et les territoires reçoivent les doses de vaccins contre la COVID‑19 afin de vacciner leurs populations le plus rapidement possible. En outre, la répartition des vaccins aux populations à haut risque en priorité était essentielle pour réduire les conséquences graves telles que les hospitalisations et les décès.
La répartition équitable des doses de vaccins
9.40 Nous avons constaté que l’Agence de la santé publique du Canada répartissait de façon équitable les doses de vaccins entre les provinces et les territoires, comme le gouvernement fédéral et les gouvernements provinciaux et territoriaux en avaient convenu en décembre 2020. Selon l’entente relative à la répartition équitable, les vaccins devaient être répartis en fonction du nombre de personnes en tenant compte de la taille des populations à haut risque ciblées par le Comité consultatif national de l’immunisation du Canada. Les provinces et les territoires avaient demandé l’envoi de doses de vaccins selon le nombre qui leur avait été attribué. Nous avons constaté que l’Agence avait livré toutes les doses de vaccins demandées par les provinces et les territoires (voir la pièce 9.2). En outre, nous avons constaté que les représentantes et représentants des gouvernements fédéral, provinciaux et territoriaux et des peuples autochtones avaient participé aux travaux de groupes de travail, de comités consultatifs et de comités directeurs tout au long de la période d’audit, ce qui a permis de prendre en considération différents points de vue avant la prise de décisions.
Pièce 9.2 — À la fin de mai 2022, l’Agence de la santé publique du Canada avait livré toutes les doses de vaccins demandées par les provinces et les territoires
| Destinataire provincial ou territorial | Taille de la population de la province ou du territoire (en milliers) |
Nombre cumulatif total de doses réparties (en milliers) |
Nombre total de doses demandées par la province ou le territoire et livrées par l’Agence (en milliers) |
|---|---|---|---|
| Ontario | 15 008 | 36 836 | 36 688 |
| Québec | 8 653 | 23 148 | 22 703 |
| Colombie‑Britannique | 5 287 | 13 404 | 12 619 |
| Alberta | 4 501 | 11 697 | 11 521 |
| Manitoba | 1 393 | 3 775 | 3 748 |
| Saskatchewan | 1 186 | 3 160 | 3 089 |
| Nouvelle‑Écosse | 1 007 | 2 624 | 2 491 |
| Nouveau‑Brunswick | 800 | 2 181 | 2 175 |
| Terre‑Neuve‑et‑Labrador | 523 | 1 498 | 1 484 |
| Île‑du‑Prince‑Édouard | 168 | 440 | 425 |
| Territoires du Nord‑Ouest | 46 | 119 | 116 |
| Yukon | 43 | 107 | 103 |
| Nunavut | 40 | 109 | 108 |
| Total | 38 655 | 99 098Note * | 97 270 |
|
Source : Agence de la santé publique du Canada et Statistique Canada |
|||
9.41 Nous avons constaté que, bien que les populations à haut risque avaient été prises en compte lors de la répartition des vaccins, l’Agence se fiait aux priorités en matière de populations établies par le Comité consultatif national de l’immunisation. L’Agence n’avait pas effectué sa propre analyse comparative entre les sexes plusDéfinition 4 comme l’exige sa politique interne et pour respecter les engagements du gouvernement fédéral.
La distribution en temps opportun aux provinces et aux territoires
9.42 Nous avons constaté que l’Agence de la santé publique du Canada avait distribué en temps opportun le nombre de doses de vaccins contre la COVID‑19 que les provinces et les territoires avaient demandées. À partir de la première livraison de vaccins en décembre 2020 jusqu’à la fin de mai 2022, les vaccins étaient livrés en moyenne deux jours après qu’une province ou un territoire les ait demandés. À notre avis, les livraisons étaient rapides étant donné la variété d’exigences logistiques auxquelles faisait face l’Agence afin de réussir à livrer les vaccins.
9.43 Nous avons aussi relevé des cas où l’Agence avait assuré une réponse rapide lorsque des provinces et des territoires faisaient face à des problèmes de livraison. Par exemple, lorsque des vaccins étaient en mauvais état à leur arrivée, l’Agence organisait un nouvel envoi. De plus, nous avons relevé des cas où, lorsque les provinces et les territoires demandaient un nombre de doses plus élevé que ce qui leur était attribué pour répondre à leurs besoins émergents, l’Agence avait assuré la liaison avec les autres provinces et territoires, lorsque cela était nécessaire, pour aider à trouver les doses demandées.
9.44 L’Agence a retenu les services des fournisseurs de soutien logistique FedEx Express Canada Corporation et Innomar Strategies inc. pour la livraison et l’entreposage des vaccins. Cela a contribué à la capacité de l’Agence de livrer des doses en temps opportun. Ces fournisseurs étaient principalement responsables d’assurer un entreposage centralisé et sécuritaire et une distribution opportune des vaccins contre la COVID‑19 aux provinces et aux territoires (y compris aux collectivités éloignées et isolées).
L’Agence de la santé publique du Canada n’a pas réussi à réduire le gaspillage de vaccins
9.45 Nous avons constaté que l’Agence de la santé publique du Canada n’avait pas réussi à réduire le gaspillage de vaccins. L’Agence avait un surplus de doses de vaccins à cause de l’obligation d’acheter les doses comme le précisaient les ententes d’achat anticipé et à cause de l’achat de doses optionnelles. Nous avons également constaté que les retards de l’Agence dans la mise en œuvre d’importantes fonctionnalités de ConnexionVaccin, le système informatique visant à appuyer la planification et la gestion des vaccins contre la COVID‑19 ainsi que la prise de décisions en lien avec le gaspillage de vaccins, avait nui à la réduction du gaspillage.
9.46 L’analyse à l’appui de cette constatation porte sur :
- les efforts infructueux de réduction du gaspillage de vaccins;
- les retards dans la mise en œuvre d’un système informatique de gestion des vaccins.
9.47 Cette constatation est importante parce que le gaspillage de vaccins engendre des coûts financiers pour la population canadienne.
9.48 Lors de la signature des ententes d’achat anticipé avec les sept compagnies de vaccins à partir de juillet 2020, il était impossible de savoir quels vaccins seraient autorisés au Canada et à quel moment ils seraient prêts à être distribués. Étant donné les réalités du marché à ce moment‑là, ces ententes comportaient des exigences contraignantes visant l’achat d’un certain nombre de doses et comprenaient des options pour l’achat de doses supplémentaires. Les ententes variaient d’un total de 20 à 76 millions de doses. En signant plusieurs ententes d’achat anticipé, les chances d’obtenir un nombre suffisant de vaccins pour combler les besoins du Canada étaient plus élevées, mais il était également possible, si tous les vaccins étaient autorisés par Santé Canada, que le Canada se retrouve avec un surplus de doses.
9.49 En juin 2021, le gouvernement fédéral s’est engagé publiquement à faire don de doses à d’autres pays qui avaient besoin de vaccins. D’autres pays ayant des doses excédentaires de vaccins s’étaient aussi engagés à en faire don.
9.50 Les vaccins ont une date de péremption qui doit être prise en considération lors de la répartition, de la distribution et du don de doses. Par exemple, il n’est pas possible de faire don de doses de vaccins dont les dates de péremption ont été reportées, car les étiquettes ne font pas état du report. Le gaspillage peut survenir pour diverses raisons. Par exemple, des doses excédentaires peuvent être gaspillées lorsqu’elles atteignent leur date de péremption ou lorsque le contrôle de la température est inefficace. La résolution des problèmes de gestion de l’approvisionnement requiert la collaboration de diverses organisations fédérales et parties prenantes, dont l’Agence de la santé publique du Canada, Services publics et Approvisionnement Canada et, dans le cas des dons internationaux, Affaires mondiales Canada.
Les efforts infructueux de réduction du gaspillage de vaccins
9.51 L’Agence de la santé publique du Canada connaissait la possibilité que les ententes d’achat anticipé entraînent des surplus de doses et avait cerné ce risque à l’été 2020. Pour atténuer ce risque, l’Agence prévoyait faire don des doses excédentaires à d’autres pays et collaborer avec les compagnies de vaccins pour gérer l’approvisionnement en vaccins.
9.52 Au 31 mai 2022, l’usage de six vaccins sur les sept vaccins potentiels avait été autorisé au Canada, entraînant un excédent de doses. Chaque autorisation d’un vaccin entraînait l’obligation d’acheter une quantité déterminée de doses et, pour toutes les ententes à l’exception d’une, l’option d’acheter des doses supplémentaires.
9.53 Nous avons constaté que l’Agence avait acheté des doses optionnelles de Pfizer et de Moderna, ce qui accentuait l’excédent de stocks. Cela a mené à un gaspillage de vaccins puisque certaines doses ont atteint leur date de péremption avant de pouvoir être utilisées ou données. Des fonctionnaires ont expliqué que, étant donné la nature évolutive de la pandémie, il était nécessaire de continuer à acheter des doses optionnelles afin d’étendre la couverture vaccinale, d’accélérer les livraisons, de remédier à la baisse de l’immunité et de s’adapter aux changements dans les lignes directrices sur l’administration des vaccins, comme des intervalles plus courts entre les doses de rappel et la recommandation d’utiliser un certain type de vaccin émise par le Comité consultatif national de l’immunisation.
9.54 Environ 169 millions de doses de vaccins ont été livrées entre décembre 2020 et la fin mai 2022. De ce nombre, quelque 124,9 millions de doses de vaccins ont été livrées au Canada. L’Agence a communiqué que la majorité de ces doses ont été administrées à des personnes au Canada. Près de 32,5 millions de doses se trouvaient dans les stocks fédéraux, provinciaux et territoriaux. À la fin de la période visée par l’audit, la majorité de ces doses restantes n’avaient pas atteint la fin de la durée de conservation et pouvaient être utilisées lors de campagnes de vaccination de rappel ou faire l’objet de dons; toutefois, la plupart atteindront leur date de péremption avant la fin de 2022 si elles demeurent inutilisées (voir la pièce 9.3). Nous avons estimé, à l’aide du coût moyen par dose que nous avons estimé selon des renseignements publics et non classifiés (voir le paragraphe 9.26), que les 32,5 millions de doses en stock à la fin de mai 2022 valaient environ 1 milliard de dollars.
Pièce 9.3 — La plupart des doses inutilisées au Canada atteindront leur date de péremption avant la fin de 2022
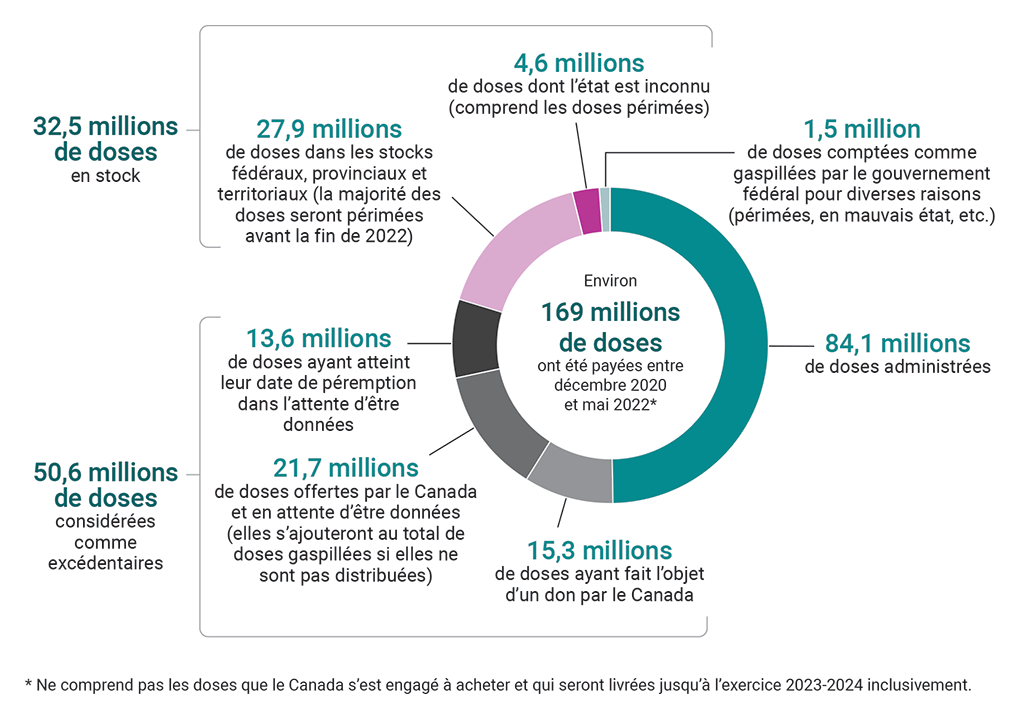
Source : Agence de la santé publique du Canada
Pièce 9.3 — version textuelle
Ce graphique en secteurs illustre la ventilation des quelque 169 millions de doses de vaccins qui ont été livrées de décembre 2020 à mai 2022. Ce chiffre ne comprend pas les doses que le Canada s’est engagé à acheter et qui seront livrées jusqu’à l’exercice 2023‑2024 inclusivement.
Environ la moitié de ces 169 millions de doses ont été administrées. Les doses restantes sont ventilées comme suit :
- Il y avait 32,5 millions de doses en stock. Parmi ces doses, il y avait 27,9 millions de doses dans les stocks fédéraux, provinciaux et territoriaux (la majorité des doses seront périmées avant la fin de 2022), et il y avait 4,6 millions de doses dont l’état est inconnu (ce chiffre comprend les doses périmées).
- Il y avait 50,6 millions de doses considérées comme excédentaires. Parmi ces doses, il y avait 15,3 millions de doses ayant fait l’objet d’un don par le Canada, 21,7 millions de doses offertes par le Canada et en attente d’être données (elles s’ajouteront au total de doses gaspillées si elles atteignent leur date de péremption avant le don) et 13,6 millions de doses ayant atteint leur date de péremption dans l’attente d’être données.
- Il y avait 1,5 million de doses comptées comme gaspillées par le gouvernement fédéral pour diverses raisons (périmées, en mauvais état, et ceteraetc.).
9.55 De plus, nous avons constaté que l’Agence n’était pas en mesure d’assurer un suivi adéquat des vaccins excédentaires et gaspillés une fois que les vaccins étaient livrés aux provinces et aux territoires. Une absence d’ententes avec les provinces et les territoires concernant l’échange des données (voir le paragraphe 9.72) a nui à la capacité de l’Agence de recueillir des renseignements sur les stocks, le gaspillage et la péremption des doses de vaccins contre la COVID‑19. Cela signifiait que l’Agence s’appuyait sur les déclarations volontaires des provinces et des territoires. Même si certaines provinces et certains territoires faisaient systématiquement rapport à l’Agence, cette dernière était incapable d’obtenir des données complètes de la majorité des provinces et des territoires. Cela signifiait que l’état de ces doses était inconnu, réduisant la capacité de l’Agence de prévoir les besoins et de planifier les dons.

Donner les moyens de vivre une vie saine et promouvoir le bien‑être de tous à tous les âges est essentiel pour le développement durable.
Source : Nations UniesNote de bas de page 1
9.56 Les dons internationaux de vaccins appuient l’objectif 3 des Objectifs de développement durable des Nations Unies, dont l’une des cibles comprend la notion de vaccins pour toutes et tous. Le gouvernement du Canada s’est engagé à faire don de l’équivalent de 200 millions de doses de vaccins contre la COVID‑19 à l’échelle internationale avant la fin de 2022. Ce nombre comprend les 50,6 millions de doses que l’Agence considérait comme excédentaires. Nous avons constaté que, en date du 31 mai 2022, seulement 15,3 millions sur ces 50,6 millions de doses avaient été données. Nous avons également constaté que, malgré un engagement visant à faire don de doses dont la durée de conservation restante était la plus longue possible (idéalement entre 14 et 16 semaines), d’autres pays avaient accepté de nombreux dons qui ne leur laissaient que de 4 à 8 semaines pour administrer les vaccins avant leur date de péremption. Des fonctionnaires nous ont indiqué qu’il existe des difficultés avec les dons qui sont hors du contrôle du Canada, notamment la volonté des autres pays à accepter les dons. En outre, de nombreux pays essaient actuellement de faire don de leurs doses excédentaires, ce qui cause un ralentissement de la demande en dons.
9.57 Recommandation — Afin de réduire davantage le gaspillage, l’Agence de la santé publique du Canada devrait s’appuyer sur les leçons tirées de sa gestion de l’approvisionnement en vaccins contre la COVID‑19 et travailler avec les autres organisations fédérales et parties prenantes concernées pour ajuster sa gestion des stocks excédentaires de vaccins contre la COVID‑19.
Réponse de l’Agence — Recommandation acceptée.
Les réponses détaillées se trouvent dans les Recommandations et réponses à la fin du présent rapport.
Les retards dans la mise en œuvre d’un système informatique de gestion des vaccins
9.58 Dans notre audit de 2021 portant sur la préparation en cas de pandémie, la surveillance et les mesures de contrôle aux frontières, nous avons repéré des lacunes de longue date dans l’infrastructure de technologie de l’information que l’Agence a utilisée pour le stockage, le traitement et l’analyse des données de surveillance sur la santé transmises par les provinces et les territoires. Plus de dix ans avant la pandémie de COVID‑19, l’Agence avait relevé des lacunes dans son infrastructure existante, sans toutefois mettre des solutions en œuvre pour l’améliorer.
9.59 Étant donné les lacunes en matière d’infrastructure, l’Agence de la santé publique du Canada a dû rapidement mettre sur pied un système permettant la gestion des vaccins durant la pandémie. En janvier 2021, Deloitte incorporéinc. a été retenu pour développer un système informatique national de gestion des vaccins (qui se nomme maintenant ConnexionVaccin). À l’aide de données provenant de l’Agence, des provinces et des territoires, le système devait fournir des renseignements en temps opportun sur la distribution, la couverture et l’innocuité des vaccins. Certaines fonctions devaient être en place avant février 2021 pour appuyer le traitement des commandes, la visibilité de la chaîne d’approvisionnement, le suivi des stocks et le suivi de la couverture vaccinale.
9.60 Nous avons constaté que, même si ConnexionVaccin était partiellement fonctionnel en juin 2021, l’Agence avait retardé le développement de certaines capacités clés du système qui auraient aidé la prise de décisions concernant le gaspillage (par exemple, le suivi des dates de péremption). La valeur estimative totale du contrat était de 59,1 millions de dollars. Nous avons observé que 37,4 millions de dollars avaient été consacrés à ConnexionVaccin à la fin de la période visée par notre audit.
9.61 L’Agence a retardé la mise en œuvre des capacités clés du système, qui n’étaient pas prêtes comme prévu en février 2021. Nous avons constaté que l’Agence avait élaboré des procédures de rechange et effectué manuellement le suivi des dates de péremption, du gaspillage et de toutes les données à partir du début de la campagne de vaccination jusqu’en juin 2021 au moyen de feuilles de calcul. Nous avons constaté que, bien que certains éléments du système étaient fonctionnels en juin 2021, l’Agence et les provinces et territoires ne les utilisaient pas tous, et l’Agence continuait à assurer le suivi des données à l’aide de feuilles de calcul.
9.62 Nous avons également constaté que l’Agence avait peu de procédures en place pour la vérification de la qualité des données, tant pour le suivi manuel que pour ConnexionVaccin. Cela a entraîné des lacunes dans les données de gestion des stocks fournies et un risque d’erreur. Par exemple, pendant notre examen des données sur les stocks, nous avons constaté que 150 000 doses semblaient avoir été livrées après leur date de péremption alors qu’elles n’étaient pas encore périmées. Bien que l’Agence ait été au courant de l’inexactitude des renseignements sur les dates de péremption depuis octobre 2021, la mise à jour des données dans ConnexionVaccin par consignation manuelle des renseignements exacts a seulement été effectuée vers la fin de la période visée par notre audit. Sans les procédures de vérification adéquates en place, l’Agence ne peut avoir l’assurance de l’exactitude des données de gestion des stocks utilisées pour la prise de décisions sur l’approvisionnement et les dons dans l’avenir.
9.63 Recommandation — L’Agence de la santé publique du Canada devrait terminer la mise en œuvre de ConnexionVaccin, qui devrait inclure des procédures pour assurer la qualité des données.
Réponse de l’Agence — Recommandation acceptée.
Les réponses détaillées se trouvent dans les Recommandations et réponses à la fin du présent rapport.
Surveillance des vaccins
Malgré des problèmes d’échange de données, l’Agence de la santé publique du Canada et Santé Canada ont réagi aux données de surveillance des vaccins
9.64 Nous avons constaté que l’Agence de la santé publique du Canada et Santé Canada avaient recueilli et analysé des données de surveillance des vaccins contre la COVID‑19 afin d’assurer le suivi de l’innocuité, de la couverture et de l’efficacité des vaccins. Nous avons constaté que les deux organisations avaient pris des mesures pour réagir aux trois signaux relatifs à la sécurité des vaccinsDéfinition 5 confirmés en se basant sur des effets secondaires qui avaient été signalés au Canada, notamment en publiant des renseignements et en exigeant des modifications à l’étiquette des vaccins. Toutefois, nous avons également constaté la persistance de certains des problèmes concernant l’échange de données de surveillance que nous avions soulevés dans quatre audits précédents. Les problèmes d’échange de données nuisaient à la capacité de l’Agence de recueillir des données désagrégées liées à la couverture vaccinale sur les caractéristiques des populations des provinces et des territoires. Ces problèmes nuisaient également à la capacité de l’Agence de communiquer des renseignements à Santé Canada, aux compagnies de vaccins et à l’Organisation mondiale de la Santé.
9.65 L’analyse à l’appui de cette constatation porte sur :
- la réaction à l’information sur l’innocuité des vaccins;
- la persistance des problèmes d’échange de données.
9.66 Cette constatation est importante parce que les données sur la surveillance des vaccins fournissent de l’information à l’Agence de la santé publique du Canada et à Santé Canada relativement aux mesures de santé publique et de réglementation nécessaires pour veiller à l’usage sécuritaire et efficace continu des vaccins contre la COVID‑19. La réaction à cette information en temps opportun peut accroître la sensibilisation aux risques possibles et aider à empêcher les effets secondaires graves de toucher plus de personnes.
9.67 La surveillance de la santé comprend la collecte, l’analyse et la diffusion continue et systématique de renseignements permettant la prise de décisions et de mesures visant à protéger la santé des populations. Les renseignements de surveillance que l’Agence de la santé publique du Canada et Santé Canada obtiennent et utilisent proviennent de plusieurs sources, notamment d’autres pays. La surveillance internationale de la santé est particulièrement importante si les vaccins sont utilisés plus tôt dans d’autres pays ou si de rares effets secondaires peuvent être détectés seulement dans des pays plus peuplés que le Canada.
9.68 Il existe trois secteurs de responsabilité en ce qui concerne la surveillance des vaccins contre la COVID‑19 : l’innocuité, la couverture et l’efficacité. Les rôles en matière de suivi de l’innocuité et de l’efficacité de l’Agence de la santé publique du Canada et de Santé Canada sont distincts et complémentaires. L’Agence est responsable du suivi de la couverture.
9.69 L’Agence et le Ministère disposaient chacun de systèmes de surveillance pour assurer le suivi de l’innocuité de tous les vaccins dont l’usage au Canada avait été autorisé avant la pandémie, et ces systèmes ont été utilisés pour la surveillance des vaccins contre la COVID‑19. Les provinces et les territoires soumettent volontairement des déclarations sur les effets secondaires suivant l’immunisationDéfinition 6 dans le Système canadien de surveillance des effets secondaires suivant l’immunisation de l’Agence. Des déclarations sont également soumises au Programme Canada Vigilance du Ministère principalement par les compagnies de vaccins, qui sont tenues de continuer à assurer le suivi de la sécurité lorsque les vaccins commencent à être utilisés au Canada. Les professionnelles et professionnels de la santé et les consommatrices et consommateurs peuvent également soumettre volontairement des renseignements au programme. Les effets secondaires font l’objet d’un suivi et sont analysés par l’Agence et le Ministère afin d’assurer l’innocuité des vaccins et de prendre des mesures adéquates lorsqu’un signal relatif à la sécurité des vaccins est décelé.
La réaction à l’information sur l’innocuité des vaccins
9.70 Nous avons constaté que l’Agence de la santé publique du Canada et Santé Canada avaient assuré le suivi de l’innocuité et de l’efficacité des vaccins contre la COVID‑19 en obtenant et en analysant des données de surveillance, notamment des études de pharmacovigilance, des rapports sur la sécurité et des déclarations d’effets secondaires suivant l’immunisation à l’échelle internationale et nationale. Depuis le début de la campagne de vaccination de masse contre la COVID‑19 au Canada, l’Agence de la santé publique du Canada et Santé Canada ont confirmé trois signaux relatifs à la sécurité basés sur des effets secondaires déclarés au Canada : la thrombose avec thrombocytopénie, la myocardite et péricardite et le syndrome de Guillain‑Barré. Ces signaux relatifs à la sécurité ont d’abord été détectés à l’extérieur du pays.
9.71 Nous avons constaté que, suivant la détection de ces signaux ailleurs dans le monde, Santé Canada avait réalisé pour chacun des trois signaux confirmés des évaluations initiales de sécurité dans un délai d’environ 14 jours en moyenne, ce qui est plus rapide que la cible de rendement de 130 jours visée hors pandémie. Nous avons également constaté ce qui suit :
- dans le cadre de sa réponse à ces signaux relatifs à la sécurité, l’Agence de la santé publique du Canada et Santé Canada avaient diffusé de l’information publique pour en informer les fournisseurs de soins de santé et l’ensemble de la population;
- après avoir conseillé aux compagnies de vaccins concernées de revoir l’étiquetage de leurs vaccins, Santé Canada avait terminé son examen des révisions fournies par les compagnies de vaccins plus rapidement que dans le cadre de la norme de service hors pandémie (passant de 165 jours à une moyenne d’environ 7 jours pour chacun des trois signaux confirmés);
- le Comité consultatif national de l’immunisation avait formulé des recommandations à l’intention des provinces et des territoires sur l’utilisation des vaccins visés.
Une réaction en temps opportun à ces signaux confirmés relatifs à la sécurité par l’Agence et le Ministère était nécessaire pour informer les professionnelles et professionnels de la santé et la population canadienne de potentiels effets secondaires graves et pour favoriser la prise de décisions éclairées relativement à l’utilisation sécuritaire des vaccins contre la COVID‑19.
La persistance des problèmes d’échange de données
9.72 Nous avons constaté la persistance de certains des problèmes relatifs à l’échange des données de surveillance qui avaient été signalés dans plusieurs audits précédents. Nous avons soulevé des problèmes en 1999, en 2002, en 2008 et, plus récemment, en 2021 dans le cadre de notre audit sur la préparation en cas de pandémie, la surveillance et les mesures de contrôle aux frontières. Dans notre audit de 2021, nous avions signalé que l’Agence n’avait pas établi de règlements pour la collecte, l’utilisation et la divulgation d’information sur la santé publique et n’avait pas déterminé, de concert avec ses partenaires provinciaux et territoriaux, quels éléments d’information sur la santé devraient être fournis, à qui et dans quel format. De plus, dans l’audit de 2021, nous avions constaté que l’infrastructure informatique de soutien n’avait pas été développée. Dans le présent audit, nous avons constaté que ces problèmes de longue date nuisaient à l’efficacité de la communication, par l’Agence de la santé publique du Canada, de données détaillées à l’échelle des cas sur la surveillance de la sécurité à Santé Canada, à l’Organisation mondiale de la Santé et aux compagnies de vaccins. Ces problèmes nuisaient également à la capacité de l’Agence de recueillir des données désagrégées liées à la couverture vaccinale sur les caractéristiques des populations (par exemple, l’ethnicité).
9.73 L’Agence de la santé publique du Canada et Santé Canada avaient des systèmes de surveillance différents déjà en place pour le suivi de l’innocuité des vaccins et les utilisaient pour obtenir et analyser des données de surveillance sur les vaccins contre la COVID‑19. Toutefois, nous avons constaté que l’Agence pouvait communiquer les renseignements reçus des provinces et des territoires par l’entremise du Système canadien de surveillance des effets secondaires suivant l’immunisation seulement lorsque les provinces et les territoires donnaient leur consentement à ce sujet. Au début avril 2021, l’Agence avait demandé la permission des provinces et des territoires afin de rendre publiquement accessibles des éléments de données particuliers du Système canadien de surveillance des effets secondaires suivant l’immunisation pour tous les partenaires, notamment à Santé Canada, à l’Organisation mondiale de la Santé et aux compagnies de vaccins, afin d’accroître la détection des signaux relatifs à la sécurité en temps opportun. La permission n’avait pas été accordée par toutes les provinces et tous les territoires étant donné certaines préoccupations en matière de protection des renseignements personnels. En outre, en juillet 2021, Santé Canada avait envoyé une demande à l’Agence dans le but d’accéder au Système canadien de surveillance des effets secondaires suivant l’immunisation pour faciliter l’examen réglementaire et la prise de décisions fondées sur des renseignements complets et à jour sur l’innocuité des vaccins contre la COVID‑19. À la fin de la période visée par notre audit, l’Agence n’avait pas reçu la permission nécessaire des provinces et des territoires pour fournir à Santé Canada l’accès au Système canadien de surveillance des effets secondaires suivant l’immunisation.
9.74 Nous avons également constaté que, selon l’Agence, le Canada est le seul pays du Groupe des septG7 qui ne suivait pas la directive de l’Organisation mondiale de la Santé demandant aux pays de lui communiquer les renseignements détaillés à l’échelle des cas des effets secondaires suivant l’immunisation contre la COVID‑19. L’Agence a communiqué des données sommaires à l’Organisation.
9.75 De plus, Santé Canada exige que les compagnies de vaccins assurent un suivi de sécurité une fois les vaccins autorisés. Les compagnies ne peuvent pas entièrement respecter cette exigence lorsqu’ils n’ont pas accès aux données requises sur les effets secondaires. Nous avons constaté que dans deux cas distincts en 2021, deux compagnies de vaccins avaient appris l’existence de déclarations de cas d’effets secondaires suivant l’immunisation du Canada par l’entremise des médias et ont par la suite demandé de toute urgence les données sous‑jacentes à l’Agence. L’Agence de la santé publique du Canada a dû demander le consentement des provinces et des territoires pour fournir les données. Nous avons constaté que, dans les deux cas, il avait fallu environ trois mois pour obtenir la permission et fournir tous les renseignements aux compagnies de vaccins.
9.76 L’autorisation d’un vaccin canadien contre la COVID‑19 et l’appui renouvelé du gouvernement pour la fabrication de nouveaux vaccins au pays, qui accroît la probabilité que d’autres vaccins soient d’abord autorisés au Canada, pourraient réduire la capacité de l’Agence de la santé publique du Canada et de Santé Canada de tirer profit de sources internationales pour les renseignements sur la surveillance des vaccins. Cela accentue également l’importance de la communication des renseignements pertinents sur la surveillance au pays et aux partenaires internationaux du Canada.
9.77 Nous avons constaté que, pour assurer le suivi de la couverture, l’Agence avait mis en place le Système canadien de surveillance de la couverture vaccinale contre la COVID‑19 au début de la pandémie. L’Agence avait initialement compilé manuellement les données soumises sur une base volontaire par les provinces et les territoires, mais en juin 2021, ces données étaient traitées de façon électronique. Toutefois, notre examen des données a montré que certaines caractéristiques de la population, telles que l’ethnicité ou le statut d’Autochtone, n’étaient pas incluses, car les provinces et les territoires ne recueillent ou ne divulguent pas toujours ces renseignements. À notre avis, sans ce type de données désagrégées, l’Agence pourrait disposer de moins de renseignements lui permettant de cibler des programmes ou des communications à l’intention de groupes qui pourraient être à risque plus élevé.
9.78 L’Agence de la santé publique du Canada et Santé Canada ont, depuis octobre 2020, dirigé des travaux avec des partenaires, notamment les provinces, les territoires et des organisations autochtones, sur la Stratégie pancanadienne de données sur la santé. La stratégie vise à renforcer les efforts déployés pour améliorer la collecte, l’échange et l’utilisation des données sur la santé. Dans un rapport de 2021, l’administratrice en chef de la santé publique du Canada faisait observer que la mise en œuvre de la Stratégie n’était pas prévue avant 2030 et encourageait l’accélération de sa mise en œuvre.
9.79 Recommandation — Étant donné l’urgence et l’importance d’améliorer l’accès opportun à des données de qualité pour les partenaires de la santé, l’Agence de la santé publique du Canada et Santé Canada devraient accélérer leurs travaux avec les provinces et les territoires pour mettre en œuvre la Stratégie pancanadienne de données sur la santé.
Réponse de chaque entité — Recommandation acceptée.
Les réponses détaillées se trouvent dans les Recommandations et réponses à la fin du présent rapport.
9.80 Recommandation — L’Agence de la santé publique du Canada, en collaboration avec Santé Canada et les provinces et territoires, devrait surmonter les obstacles pour :
- assurer une meilleure communication des renseignements de surveillance entre eux;
- fournir un accès au Système canadien de surveillance des effets secondaires suivant l’immunisation à Santé Canada;
- fournir en temps opportun des données de surveillance, y compris des renseignements à l’échelle des cas, au besoin, à l’Organisation mondiale de la Santé et aux compagnies de vaccins.
Réponse de l’Agence — Recommandation acceptée.
Les réponses détaillées se trouvent dans les Recommandations et réponses à la fin du présent rapport.
Conclusion
9.81 Nous avons conclu que Services publics et Approvisionnement Canada avait fourni un soutien efficace en matière d’approvisionnement et avait obtenu un nombre suffisant de doses de vaccins contre la COVID‑19 pour la population canadienne.
9.82 Nous avons également conclu que l’Agence de la santé publique du Canada et Santé Canada avaient assuré un accès aux vaccins contre la COVID‑19 de façon efficace. Santé Canada a accéléré son processus de réglementation pour autoriser les vaccins, et l’Agence de la santé publique du Canada a distribué en temps opportun les doses de vaccins aux provinces et aux territoires. Toutefois, l’Agence n’a pas réussi à réduire le gaspillage de vaccins.
9.83 Enfin, nous avons conclu que l’Agence de la santé publique du Canada et Santé Canada avaient réagi en temps opportun aux trois signaux relatifs à la sécurité confirmés basés sur les effets secondaires déclarés au Canada. Toutefois, des problèmes de longue date liés à l’échange de données qui avaient été relevés lors d’audits précédents ont nui à l’efficacité de la communication, par l’Agence, de données détaillées à l’échelle des cas sur la surveillance de la sécurité à Santé Canada, à l’Organisation mondiale de la Santé et aux compagnies de vaccins.
À propos de l’audit
Le présent rapport de certification indépendant sur les vaccins contre la COVID‑19 a été préparé par le Bureau du vérificateur général du Canada. Notre responsabilité était de donner de l’information, une assurance et des avis objectifs au Parlement en vue de l’aider à examiner soigneusement la gestion que fait le gouvernement des ressources et des programmes et d’exprimer une conclusion quant à la conformité des organisations fédérales visées en ce qui concerne les vaccins contre la COVID‑19, dans tous ses aspects importants, aux critères applicables.
Tous les travaux effectués dans le cadre du présent audit ont été réalisés à un niveau d’assurance raisonnable conformément à la Norme canadienne de missions de certification (NCMC) 3001 — Missions d’appréciation directe de Comptables professionnels agréés du Canada (CPA Canada), qui est présentée dans le Manuel de CPA Canada — Certification.
Le Bureau du vérificateur général du Canada applique la Norme canadienne de contrôle qualité 1 et, en conséquence, maintient un système de contrôle qualité exhaustif qui comprend des politiques et des procédures documentées en ce qui concerne la conformité aux règles de déontologie, aux normes professionnelles et aux exigences légales et réglementaires applicables.
Lors de la réalisation de nos travaux d’audit, nous nous sommes conformés aux règles sur l’indépendance et aux autres règles de déontologie des codes de conduite pertinents applicables à l’exercice de l’expertise comptable au Canada, qui reposent sur les principes fondamentaux d’intégrité, d’objectivité, de compétence professionnelle et de diligence, de confidentialité et de conduite professionnelle.
Conformément à notre processus d’audit, nous avons obtenu ce qui suit de la direction de l’entité :
- la confirmation de sa responsabilité à l’égard de l’objet considéré;
- la confirmation que les critères étaient valables pour la mission;
- la confirmation qu’elle nous a fourni tous les renseignements dont elle a connaissance et qui lui ont été demandés ou qui pourraient avoir une incidence importante sur les constatations ou la conclusion contenues dans le présent rapport;
- la confirmation que les faits présentés dans le rapport sont exacts.
Objectif de l’audit
L’objectif de l’audit consistait à déterminer si :
- Services publics et Approvisionnement Canada avait fourni un soutien adéquat en matière d’approvisionnement pour obtenir des vaccins contre la COVID‑19;
- l’Agence de la santé publique du Canada et Santé Canada avaient assuré un accès aux vaccins contre la COVID‑19 de façon efficace;
- la surveillance exercée par l’Agence de la santé publique du Canada et Santé Canada des vaccins contre la COVID‑19 était efficace et opportune.
Étendue et méthode
L’étendue de l’audit comprenait les trois principales organisations fédérales qui ont contribué à la mise en œuvre du Plan de vaccination du Canada contre la COVID‑19 : sauver des vies et protéger les moyens de subsistance, soit l’Agence de la santé publique du Canada, Santé Canada et Services publics et Approvisionnement Canada.
Nous avons mené des entretiens avec des fonctionnaires ayant participé dans les différents domaines qui faisaient partie de l’étendue de notre audit. Nous avons également mené des entrevues avec des fonctionnaires du Conseil national de recherches Canada, lequel était responsable du secrétariat du Groupe de travail sur les vaccins contre la COVID‑19, afin d’obtenir la documentation.
Nous n’avons pas audité la qualité des décisions fondées sur la science ni le jugement scientifique dans nos travaux d’audit.
Dans le cadre de nos travaux d’audit au sujet de l’approvisionnement, nous avons examiné les mesures prises par Services publics et Approvisionnement Canada pour obtenir un nombre suffisant de vaccins. Nous avons examiné la documentation de sept ententes d’achat anticipé. Étant donné les clauses de confidentialité de ces ententes, nous sommes limités dans ce que nous pouvons inclure dans ce rapport. Pour estimer un coût moyen par dose, nous avons utilisé des renseignements non classifiés et des renseignements disponibles dans les Comptes publics du Canada. Les Comptes publics du Canada ont agrégé les montants déboursés pour les vaccins, ce qui comprend les paiements anticipés, et les produits thérapeutiques. Le montant déboursé est un montant global, car il n’y a pas de renseignements accessibles au public faisant état du montant exact payé aux compagnies de vaccins pour les vaccins contre la COVID‑19. Nous voulions ainsi respecter les clauses de confidentialité des ententes. Le coût moyen estimé est une approximation raisonnable du coût réel moyen par dose.
Nous avons examiné les documents clés préparés par Santé Canada pour autoriser les différents vaccins pour vérifier si les étapes du processus accéléré avaient été suivies. Nous avons également examiné les documents liés au cadre d’assurance de la qualité en place.
Nous avons examiné les documents et analysé les données en lien avec les éléments suivants :
- la répartition et la distribution des vaccins (de l’Agence de la santé publique du Canada);
- la surveillance des vaccins (de l’Agence de la santé publique du Canada et de Santé Canada).
Dans le présent rapport d’audit, nous avons constaté que l’Agence de la santé publique du Canada avait peu de procédures en place pour la vérification de la qualité de ses données de gestion des stocks. Même si nous sommes confiants quant à la justesse de nos analyses et de nos observations présentées dans ce rapport, nous tenons à souligner qu’elles s’appuient sur les données de l’Agence dont nous disposions.
Le présent audit a contribué aux efforts du Canada à l’égard de la réalisation de l’objectif de développement durable des Nations Unies numéro 3 : « Bonne santé et bien‑être ».
Critères
Nous avons utilisé les critères suivants pour déterminer si :
- Services publics et Approvisionnement Canada avait fourni un soutien adéquat en matière d’approvisionnement pour obtenir des vaccins contre la COVID‑19;
- l’Agence de la santé publique du Canada et Santé Canada avaient assuré un accès aux vaccins contre la COVID‑19 de façon efficace;
- la surveillance exercée par l’Agence de la santé publique du Canada et Santé Canada des vaccins contre la COVID‑19 était efficace et opportune.
| Critères | Sources |
|---|---|
|
L’Agence de la santé publique du Canada détermine de façon efficace, en se fondant sur des conseils scientifiques disponibles à ce moment, les spécifications nécessaires à l’obtention des vaccins contre la COVID‑19. |
|
|
Services publics et Approvisionnement Canada gère l’approvisionnement en vaccins contre la COVID‑19 de façon efficiente, en faisant preuve de diligence raisonnable, afin de respecter les spécifications établies par l’Agence de la santé publique du Canada. |
|
|
Santé Canada suit le processus d’autorisation établi pour les vaccins contre la COVID‑19. |
|
|
L’Agence de la santé publique du Canada répartit les vaccins contre la COVID‑19 de façon efficiente et équitable. |
|
|
L’Agence de la santé publique du Canada distribue efficacement les vaccins contre la COVID‑19. |
|
|
L’Agence de la santé publique du Canada et Santé Canada recueillent et analysent des données exactes et opportunes sur la surveillance des vaccins contre la COVID‑19 afin d’assurer le suivi de l’innocuité, de la couverture et de l’efficacité de ceux‑ci, et de prendre des mesures de santé publique et réglementaires, au besoin. |
|
Période visée par l’audit
L’audit a porté sur la période allant du 1er janvier 2020 au 31 mai 2022. Il s’agit de la période à laquelle s’applique la conclusion de l’audit. Toutefois, afin de mieux comprendre l’objet considéré de l’audit, nous avons aussi examiné certains dossiers antérieurs à cette période.
Date du rapport
Nous avons fini de rassembler les éléments probants suffisants et appropriés à partir desquels nous avons fondé notre conclusion le 29 septembre 2022, à Ottawa, au Canada.
Équipe d’audit
L’audit a été réalisé par une équipe multidisciplinaire du Bureau du vérificateur général du Canada dirigée par Susan Gomez, directrice principale. La directrice principale est responsable de la qualité de l’audit dans son ensemble. Elle doit s’assurer notamment que les audits sont exécutés conformément aux normes professionnelles, aux exigences des textes légaux et réglementaires applicables ainsi qu’aux politiques et au système de contrôle qualité du BVG.
Recommandations et réponses
Dans ce tableau, le numéro du paragraphe qui précède la recommandation indique l’emplacement de la recommandation dans le rapport.
| Recommandation | Réponse |
|---|---|
|
9.57 Afin de réduire davantage le gaspillage, l’Agence de la santé publique du Canada devrait s’appuyer sur les leçons tirées de sa gestion de l’approvisionnement en vaccins contre la COVID‑19 et travailler avec les autres organisations fédérales et parties prenantes concernées pour ajuster sa gestion des stocks excédentaires de vaccins contre la COVID‑19. |
Recommandation acceptée. Dès le début de la pandémie, l’objectif principal du gouvernement du Canada a été de s’assurer que le Canada ait rapidement accès aux vaccins les plus efficaces pour protéger la santé et la sécurité des Canadiens. Les plans d’approvisionnement en vaccins contre la COVID‑19 du Canada ont évolué tout au long de la pandémie, en fonction des nouvelles données scientifiques, des délais d’approbation réglementaire, de la disponibilité des produits, des directives du Comité consultatif national de l’immunisation et des besoins fédéraux, provinciaux et territoriaux. L’Agence de la santé publique du Canada examinera les leçons apprises et collaborera avec d’autres ministères et les intervenants concernés afin d’optimiser la gestion de l’approvisionnement en vaccins contre la COVID‑19 et de réduire les surplus et le gaspillage de doses de vaccins contre la COVID‑19 tout au long de la durée des contrats. Ces efforts constants comprendront ce qui suit :
L’Agence s’inspirera également des enseignements tirés de la COVID‑19 pour orienter la planification de l’approvisionnement en vaccins pour les futures pandémies (décembre 2024). |
|
9.63 L’Agence de la santé publique du Canada devrait terminer la mise en œuvre de ConnexionVaccin, qui devrait inclure des procédures pour assurer la qualité des données. |
Recommandation acceptée. L’Agence de la santé publique du Canada travaille activement à faire progresser la mise en œuvre ainsi que les procédures de contrôle de la qualité des données des trois modules de ConnexionVaccin, à savoir la Chaîne d’approvisionnement intelligente (CAI), le Système d’information sur l’immunisation (SII) et la Gestion du programme d’immunisation (GPI). L’Agence continuera de solliciter activement la participation des juridictions partenaires pour cerner les lacunes et les besoins en matière de services afin de soutenir l’intégration future des systèmes. Forte des investissements réalisés à ce jour dans le module de la CAI de ConnexionVaccin, l’Agence collaborera étroitement avec d’autres ministères fédéraux ainsi qu’avec ses partenaires provinciaux et territoriaux pour soutenir la gestion de la chaîne d’approvisionnement ainsi que la distribution des vaccins. Le Système d’information sur l’immunisation (SII) remplacera le Système canadien de surveillance des effets secondaires suivant l’immunisation (SCSESSI). L’Agence de la santé publique du Canada mettra à l’essai et validera la version infonuagique du SCSESSI afin de se préparer au lancement du produit minimal viable prévu pour l’automne 2022. L’élaboration du module Gestion du programme d’immunisation (GPI) est terminée, et un certain nombre de juridictions l’ont utilisé pendant le déploiement de la campagne de vaccination contre la COVID‑19. |
|
9.79 Étant donné l’urgence et l’importance d’améliorer l’accès opportun à des données de qualité pour les partenaires de la santé, l’Agence de la santé publique du Canada et Santé Canada devraient accélérer leurs travaux avec les provinces et les territoires pour mettre en œuvre la Stratégie pancanadienne de données sur la santé. |
Réponse de l’Agence de la santé publique du Canada — Recommandation acceptée. L’Agence de la santé publique du Canada a créé la Direction générale des données de gestion et de la surveillance en octobre 2020 afin de soutenir son engagement à continuer d’améliorer la collecte, la diffusion et l’utilisation des données sur la santé, en réponse à la recommandation 8.66 des Rapports de la vérificatrice générale du Canada de 2021, Rapport 8, Préparation en cas de pandémie, surveillance et mesures de contrôle aux frontières. L’Agence et Santé Canada ont travaillé avec les provinces et les territoires afin d’élaborer conjointement la Stratégie pancanadienne de données sur la santé. Cette stratégie permettra de s’attaquer aux problèmes persistants qui nuisent à la capacité du Canada de recueillir, de diffuser, d’accéder et d’utiliser les données sur la santé. La mise en œuvre sera orientée par des politiques et des cadres harmonisés ainsi que sur un plan de travail intégré. Un examen est prévu tous les trois ans. Le rythme de la mise en œuvre tiendra compte des capacités et de l’état de préparation de chaque juridiction, et des possibilités d’accélérer la mise en œuvre par la collaboration. Réponse de Santé Canada — Recommandation acceptée. Santé Canada continuera de travailler avec l’Agence de la santé publique du Canada afin de faire progresser l’élaboration et la mise en œuvre de la Stratégie pancanadienne de données sur la santé, en collaboration avec les provinces et les territoires. |
|
9.80 L’Agence de la santé publique du Canada, en collaboration avec Santé Canada et les provinces et territoires, devrait surmonter les obstacles pour :
|
Recommandation acceptée. L’Agence de la santé publique du Canada comprend que l’échange d’information est une composante importante du système canadien de surveillance de l’innocuité des vaccins, qui est le fruit d’une collaboration entre les provinces et les territoires, l’Agence, Santé Canada et les fabricants de vaccins, et elle continuera de favoriser un meilleur échange de renseignements avec ses partenaires. L’Agence mène des consultations avec ses partenaires provinciaux et territoriaux concernant une proposition visant à fournir à Santé Canada un accès au Système canadien de surveillance des effets secondaires suivant l’immunisation (SCSESSI). Le SCSESSI reçoit des rapports de toutes les autorités de santé publique provinciales et territoriales et de certains ministères fédéraux. Certaines provinces et certains territoires ont imposé des conditions quant à l’accès et l’utilisation des renseignements sur la santé qu’ils fournissent à l’Agence. L’Agence continuera de transmettre des données du SCSESSI sous forme agrégée à l’Organisation mondiale de la Santé (OMS), selon un calendrier régulier, et aux fabricants de vaccins, selon les besoins. L’Agence collaborera avec les provinces et les territoires afin de pouvoir communiquer des données plus détaillées à l’OMS et aux fabricants de vaccins, au besoin, tout en étant reconnaissant de l’importance de protéger la vie privée des patients, de respecter les lois sur la protection des renseignements personnels, et de favoriser une interprétation exacte des données. |
